ऊष्मा (Heat)
- ऊष्मा ऊर्जा का एक रूप है जिसका स्थानांतरण दो अथवा अधिक निकायों के बीच अथवा किसी निकाय तथा उसके परिवेश में ताप में अंतर के कारण होता है।
- ऊष्मा का SI पद्धति में मात्रक जूल होता है।
- ऊष्मा का CGS पद्धति में मात्रक कैलोरी होता
1 जूल = 0.24 कैलोरी
1 कैलोरी = 4.186 जूल
तापमान (Temperature)
- कोई वस्तु कितनी गर्म (उष्ण) अथवा ठंडी है, इसकी मात्रात्मक इकाई ताप होती है।
- ताप के मात्रक डिग्री सेंटीग्रेड (°C), फारेनहाइट (°F)आदि होते हैं।
- इसका SI मात्रक केल्विन (K) है।
गलनांक (Melting point)
- वह निश्चित ताप जिस पर ठोस पदार्थ द्रव अवस्था में परिवर्तित हो जाए, उसे उस पदार्थ का ‘गलनांक’ कहते हैं।
हिमांक (Freezing Point)
- वह निश्चित ताप जिस पर कोई द्रवित पदार्थ ठोस पदार्थ में परिवर्तित हो जाता है, उसे उस पदार्थ का ‘हिमांक’ कहते हैं तथा यह प्रक्रिया ‘हिमीकरण’ कहलाती है।
क्वथनांक (Boiling point)
- वह ताप जिस पर द्रव का वाष्पदाब वायुमंडलीय दाब के बराबर हो जाए, उस द्रव का ‘क्वथनांक’ कहलाता है।
- द्रव में अशुद्धियाँ मिला देने से उसका क्वाथनांक बढ़ जाता है।
- ऊँचाई पर वायुमंडलीय दाब कम होने के कारण ही जल 100°C से कम तापमान पर ही उबलने लगता है।
- जल के लिये वास्तविक क्वाथनांक 100°C होता है।
- पानी में नमक मिलाने पर उसका क्वथनांक बढ़ जाता है, जबकि हिमांक घट जाता है।
- दाब बढ़ाने से क्वथनांक बढ़ जाता है। यही कारण है कि प्रेशर कुकर में खाना पकने में कम समय लगता है।
ताप मापन के विभिन्न पैमाने
सेल्सियस पैमाना (Celsius Scale)
- इस पैमाने पर जल के क्वथनांक को 100°C तथा हिमांक को0°C लिया जाता है।
केल्विन पैमाना (Kelvin Scale)
- इस पैमाने पर जल के क्वथनांक को 373.15 तथा हिमांक को 273.15 लिया जाता है।
- इन दोनों के बीच की दूरी को 100 बराबर भागों में बाँट लेते हैं।
फॉरेनहाइट पैमाना (Fahrenheit Scale)
- इस पैमाने पर जल के हिमांक को 32°F तथा क्वथनांक को 212°F लेते हैं तथा 32°F और 212°F के बीच की दूरी को 180 बराबर भागों में बाँट देते हैं।
रोमर पैमाना
- इस पैमाने पर जल का हिमांक 0° R तथा भाप-बिंदु 80° R है।
- उनके बीच के भाग को 80 बराबर भागों में बाँट देते हैं।
- 40°C ऐसा तापक्रम है, जहाँ डिग्री सेंटीग्रेड और फॉरेनहाइट का पाठ्यांक एक ही होता है।
परम शून्य (Absolute Zero)
- सैद्धांतिक रूप से किसी वस्तु का ताप -273.15°C से कम संभव नहीं है।
- इसे ‘परम शून्य ताप’ कहते हैं। केल्विन पैमाने पर इसे OK से प्रदर्शित करते हैं।
ताप मापन के विभिन्न यंत्र
डॉक्टरी तापमापी (Thermometer)
- यह मानव शरीर का ताप मापने के लिये प्रयुक्त किया जाता है।
- मानव शरीर का सामान्य तापक्रम 98.4°F होता है, जो सेल्सियस पैमाने पर 36.89°C होता है।
तापयुग्म तापमापी (Thermocouple Thermometer)
- यह सीबेक प्रभाव पर आधारित है। इससे – 200°C से 1600°C तक के ताप को मापा जा सकता है।
प्लैटिनम प्रतिरोध तापमापी
- इस तापमापी की सहायता से – 200°C से 1000°C तक का ताप मापा जा सकता है।
पूर्ण विकिरण उत्तापमापी (Total Radiation Pyrometer)
- यह स्टीफन के नियम पर आधारित है।
- इसकी सहायता से बहुत दूरी पर स्थित तथा बहुत ऊँचे ताप वाली वस्तुओं का ताप मापन किया जाता है।
- सूर्य एवं तारों के ताप मापन के लिये इसका प्रयोग करते हैं।
गुप्त ऊष्मा (Latent heat)
- स्थिर ताप पर पदार्थ को अपनी अवस्था को परिवर्तित करने के लिये ऊष्मा की जितनी मात्रा की आवश्यकता होती है अथवा अवस्था परिवर्तन के दौरान पदार्थ ऊष्मा की जितनी मात्रा वातावरण में उन्मुक्त करते हैं; ऊष्मा की इस मात्रा को पदार्थ की ‘गुप्त ऊष्मा’ कहते हैं।
- यदि पदार्थ की गुप्त ऊष्मा L है तो m द्रव्यमान की अवस्था परिवर्तन के लिये आवश्यक ऊष्मा Q = mL होगी। इसका SI मात्रक जूल/ किग्रा. है।
गलन की गुप्त ऊष्मा (Latent Heat of Fusion )
- स्थिर ताप पर किसी ठोस के एकांक द्रव्यमान को द्रव में बदलने के लिये आवश्यक ऊष्मा की मात्रा को उस ठोस की गलन की ‘गुप्त ऊष्मा’ कहते हैं।
- बर्फ के लिये इसका मान 80 कैलरी/ग्राम है।
- 0°C पर पिघलने वाली बर्फ में यदि कुछ नमक या शोरा मिला दिया जाए तो इसका गलनांक -22°C तक कम हो जाता है।
वाष्पन की गुप्त ऊष्मा (Latent Heat of Vaporization)
- स्थिर ताप पर द्रव के एकांक द्रव्यमान को वाष्प में बदलने के लिये आवश्यक ऊष्मा की मात्रा को द्रव की वाष्पन की ‘गुप्त ऊष्मा’ कहते हैं।
- जल के लिये इसका मान 540 कैलोरी/ग्राम है।
- यही कारण है कि 100°C के ताप वाले जल से जलने की अपेक्षा इसी ताप पर भाप जलना ज्यादा गंभीर होता है, क्योंकि भाप में अधिक ऊष्मा संचित होती है।
विशिष्ट ऊष्मा (Specific Heat)
- किसी पदार्थ के 1 ग्राम द्रव्यमान का ताप 1°C बढ़ाने के लिये ऊष्मा की आवश्यक मात्रा को उस पदार्थ की ‘विशिष्ट ऊष्मा’ कहते हैं।
- थर्मोस्टेट किसी निकाय के तापमान को स्थिर रखने का कार्य करता है।
- यह ऊर्जा की बचत करने में सहायक है।
ऊष्मीय प्रसार (Thermal Expansion)
- अधिकांश पदार्थ गर्म करने पर प्रसारित होते हैं तथा शीतलन पर सिकुड़ते हैं।
- किसी वस्तु के ताप में परिवर्तन होने पर उसकी विमाओं में भी परिवर्तन हो जाता है।
- ताप वृद्धि होने पर विमाओं की वृद्धि को तापीय प्रसार कहते हैं।
- लंबाई में प्रसार को रेखिक प्रसार (α) कहते हैं।
- क्षेत्रफल में प्रसार को ‘क्षेत्र प्रसार’ (β) एवं आयतन में प्रसार को ‘आयतन प्रसार’ (γ) कहते हैं।
- α,βऔरγ में संबंध α: β: γ: : 1:2:3
- तापीय प्रसार के गुण के कारण गर्मियों में रेल की पटरियाँ कुछ लंबी हो जाती हैं, इसीलिये पटरियों को जोड़ने के दौरान उनके बीच थोड़ी जगह छोड़ दी जाती है।
जल का असामान्य प्रसार
- सामान्यतः सभी द्रवों को गर्म करने पर उनके आयतन में वृद्धि होती है, परंतु जल को 0°C से 4°C तक गर्म करने पर इसके आयतन में कमी होती है तथा 4° C के बाद आयतन में वृद्धि होनी शुरू हो जाती है। जल का 4° C पर न्यूनतम आयतन होने के कारण घनत्व अधिकतम होता है।
- जल के इसी विशिष्ट गुण के कारण जाड़े में झील की सतह जम जाती है, परंतु सतह के नीचे जल द्रव अवस्था में ही रहता है।
ऊष्मा का संचरण
- ऊष्मा का एक स्थान से दूसरे स्थान तक जाने को ऊष्मा का संचरण कहते हैं।
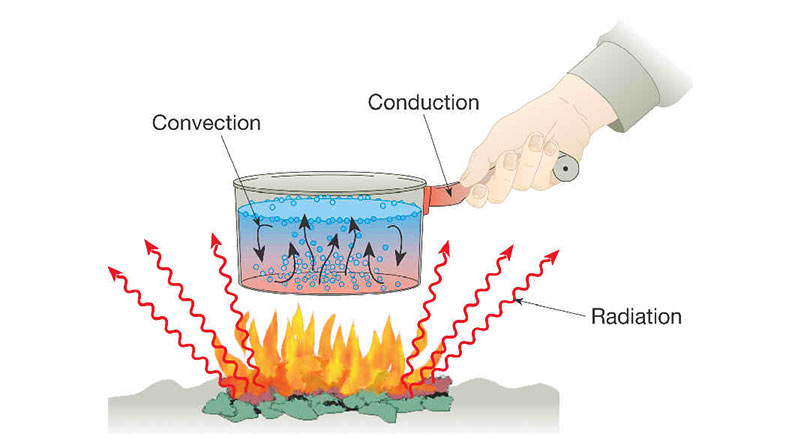
- ऊष्मा का संचरण तीन प्रकार से संभव है- (1) चालन (2) संवहन (3) विकिरण ।
चालन (Conduction )
- जब किसी वस्तु के दोनों सिरों (छोरों) के तापों में अंतर पाया जाता है तब गर्म सिरे से ठंडे सिरे की ओर ऊष्मा स्थानांतरण की प्रक्रिया को ‘चालन’ कहते हैं।
- चालन की प्रक्रिया में पदार्थ के कणों की गति नहीं होती है।
- धातुओं में ऊष्मा का संचरण चालन द्वारा होता है।
- यदि धातु की एक छड़ के शिरे को गर्म करें तो दूसरा शिरा भी कुछ देर बाद गर्म हो जाता है।
- इसीलिये धातु के बर्तनों के हैंडल पर ऊष्मा के कुचालक पदार्थों का उपयोग किया जाता है।
संवहन (Convection)
- यह ऊष्मा संचरण की वह विधि है, जिसमें ऊष्मा का स्थानांतरण पदार्थ एवं गैसों के कणों की वास्तविक गति द्वारा होता है।
- संवहन की प्रक्रिया तरल पदार्थों में ही संभव है; ठोसों में संवहन प्रक्रिया द्वारा ऊष्मा का स्थानांतरण नहीं होता है। उदाहरण: वायुमंडल का गर्म होना।
विकिरण (Radiation)
- ऊष्मा स्थानांतरण की चालन तथा संवहन की विधियों में ऊष्मा के स्थानांतरण के लिये माध्यम की आवश्यकता होती है, परंतु विकिरण ऊष्मा स्थानांतरण की वह विधि है, जिसमें ऊष्मा के स्थानांतरण के लिये माध्यम की आवश्यकता नहीं होती है।
- उदाहरण: सूर्य के ताप से पृथ्वी का गर्म होना, पास जलती हुई अँगीठी की आग से गर्मी महसूस करना आदि।
उत्सर्जन क्षमता (Emission power)
- किसी वस्तु के एक इकाई क्षेत्रफल से एकांक समय में उत्सर्जित होने वाली विकिरण की मात्रा को उस वस्तु की ‘उत्सर्जन क्षमता’ कहते हैं।
न्यूटन का शीतलन नियम (Newton’s law of cooling)
- विकिरण द्वारा किसी वस्तु के ठंडे होने की दर वस्तु तथा उसके चारों ओर के माध्यम के तापांतर के अनुक्रमानुपाती होती है।
विकिरण के संबंध में किरचॉफ (Kirchoff’s Law) का नियम
- अच्छा अवशोषक अच्छा उत्सर्जक होता है।
- सरल शब्दों में कोई वस्तु जितनी आसानी से विकिरण ऊर्जा का अवशोषण करेगी, उतनी ही आसानी से अवशोषित ऊर्जा का उत्सर्जन भी करेगी।
ऊष्मीय विकिरण के संदर्भ में स्टीफन बौल्टज्मैन का नियम (Stefan-Boltzmann Law)
- किसी वस्तु के एक इकाई क्षेत्रफल से उत्सर्जित ऊष्मीय ऊर्जा की दर, उस वस्तु के परमताप (Absolute Temperature) के चौथे घात अनुक्रमानुपाती होती है।
ऊष्मा का अवशोषण (Absorption of Heat)
- जब ऊष्मीय विकिरण किसी वस्तु/पिंड पर पड़ता है तो पिंड के गुणों के अनुसार ऊष्मीय विकिरण का कुछ भाग परावर्तित हो जाता है. तथा कुछ भाग अवशोषित हो जाता है।
- परावर्तन तथा अवशोषण की मात्रा वस्तु के रंग से निर्धारित होती है।
- काले रंग के पिंड से ऊष्मा का अवशोषण तथा उत्सर्जन दोनों अधिक मात्रा में होता है, जबकि सफेद रंग से सबसे कम अवशोषण और उत्सर्जन होता है।
- उदाहरण स्वरूप, गर्मियों में सफेद वस्त्र सबसे अच्छा माना जाता है।
आपेक्षिक आर्द्रता (Relative Humidity)
- वायु में उपस्थित जलवाष्प की मात्रा आर्द्रता कहलाती है।
- एकताप पर वायु के निश्चित आयतन में उपस्थित जलवाष्प की मात्रा तथा उसी निश्चित ताप पर उतने ही आयतन की वायु को संतृप्त करने के लिये आवश्यक जलवाष्प की मात्रा का अनुपात ‘आपेक्षिक आर्द्रता’ कहलाता है।
- आपेक्षिक आर्द्रता प्रतिशत=निश्चित ताप (T) तथा आयतन(v) की वायु में जल वाष्प की मात्रा / उसी ताप तथा आयतन पर संतृप्त वायु में जलवाष्प की मात्रा
- आपेक्षिक आर्द्रता मापने के लिये हाइग्रोमीटर का उपयोग किया जाता है। इसे प्रतिशत में व्यक्त करते हैं।
- संतृप्त अवस्था का तात्पर्य यह है कि एक निश्चित ताप पर वायु जलवाष्प की निश्चित मात्रा को ही ग्रहण कर सकती है।
- अतः जब वायु एक निश्चित ताप पर जलवाष्प की अधिकतम मात्रा ग्रहण कर लेती है तो वायु को ‘संतृप्त वायु’ कहते हैं।
वाष्पीकरण (Vaporization)
- पदार्थ की द्रव अवस्था से वाष्प अवस्था में होने वाले परिवर्तन को पदार्थ का ‘वाष्पीकरण’ कहते हैं।
- वाष्पीकरण की दर द्रव की खुली सतह के क्षेत्रफल पर भी निर्भर करती है।
- यदि खुली सतह का क्षेत्रफल ज्यादा होगा तो वाष्पीकरण की दर भी अधिक होगी।
- इसके अलावा द्रव का ताप बढ़ने से भी वाष्पीकरण की दर बढ़ती है।
- उदाहरणस्वरूप गर्मियों के दौरान प्रयोग में आने वाले कूलर वाष्पीकरण के द्वारा ही वायु को ठंडा करते हैं।
- मिट्टी का घड़ा भी वाष्पीकरण के द्वारा जल को ठंडा करता है।
ऊष्मागतिकी के नियम (Law of Thermodynamics)
ऊष्मागतिकी का प्रथम नियम (First Law of thermodynamics)
- यह ऊर्जा संरक्षण के नियम पर आधारित है।
- इस नियम के अनुसार किसी निकाय को दी गई ऊर्जा का कुछ अंश उस निकाय की आंतरिक ऊर्जा की वृद्धि में खर्च होता है तथा शेष भाग निकाय द्वारा परिवेश पर कार्य करने में।
- नोटः ऊष्मा और कार्य ऊष्मागतिकी में ऊर्जा स्थानांतरण की विधि है।
- ऊष्मा तथा कार्य के प्रभाव से निकाय की आंतरिक ऊर्जा परिवर्तित होती है।
आंतरिक ऊर्जा (Internal Energy )
- कोई भी निकाय/पदार्थ अनगिनत अणुओं से मिलकर बना होता है, इन्हीं समस्त अणुओं की गतिज तथा स्थितिज ऊर्जा का योग ही निकाय/ पदार्थ की आंतरिक ऊर्जा कहलाती है।
ऊष्मागतिकी का द्वितीय नियम (Second law of thermo-dynamics)
- जब तक कोई बाह्य कार्य नहीं किया जाता है, ठंडी वस्तु से किसी गर्म वस्तु की ओर ऊष्मा का स्थानांतरण नहीं होता है।
- केल्विन और प्लांक के अनुसार ऐसा संभव नहीं है कि ऊष्मा की पूरी मात्रा को कार्य में परिवर्तित कर दिया जाए।
ऊष्मागतिक निकाय (Thermodynamic System)
- कोई भी ऐसा निकाय (System) जिसकी अवस्था ताप, दाब और आयतन के पदों में व्यक्त की जा सके, ‘ऊष्मा गतिक निकाय’ कहलाता है।
- उदाहरण: सिलिंडर में भरी हुई गैस ।
ऊष्मागतिक प्रक्रम (Thermodynamic Process)
चक्रीय प्रक्रम (Cyclic Process)
- चक्रीय प्रक्रम में कोई निकाय विभिन्न प्रावस्थाओं से गुजरता हुआ अपनी प्रारंभिक अवस्था में वापस आ जाता है।
- चूँकि निकाय की प्रारंभिक और अंतिम अवस्था एक रहती है, इसलिये चक्रीय प्रक्रम में ऊष्मागतिक परिवर्तन शून्य होता है।
रुद्धोष्म प्रक्रम (Adiabatic Process)
- जब संपूर्ण प्रक्रम में निकाय द्वारा बाह्य वातावरण से ऊष्मा का विनिमय (आदान-प्रदान) नहीं किया जाता है तो उसे ‘रुद्धोष्म प्रक्रम’ कहते हैं।
- उदाहरण: मोटरगाड़ी के टायर का ट्यूब फटने पर हवा का ठंडा होना।
- जब टायर का ट्यूब फटता है तो वायु बाहर के वातावरण से ऊर्जा ग्रहण नहीं कर पाती है और वायु के प्रसार के लिये आवश्यक ऊर्जा अपनी आंतरिक ऊर्जा से ग्रहण करती है, जिससे वायु ठंडी लगती है।
- वायुमंडल में वायुराशियों की गति भी रुद्धोष्म प्रक्रम का उदाहरण है।